神经发育过程高度协调,涉及祖细胞和神经元的精确时空调控。尽管目前已知转录调节因子在神经元分化中扮演重要角色,与多种神经发育障碍例如智力障碍、自闭症、注意力缺陷、脑瘫等发病机理密切相关,但控制神经发育众多事件的调节机制仍不明晰。
KDM5C作为一种关键的表观遗传学调节因子,其突变与X连锁智力障碍(X-linked intellectual disability)和自闭症有关,是X连锁智力障碍中最常发生突变的基因之一。KDM5C突变患者表现出不同程度的认知和行为障碍,且小鼠模型亦呈现出类似的学习记忆缺陷。然而,KDM5C如何精确调控神经元分化、其缺失导致认知障碍的具体发育时间点仍不明确。因此,深入研究KDM5C在大脑发育中的功能对于理解神经疾病的病理学至关重要。
为了揭秘KDM5C导致认知障碍的确切机制。2024年2月21日,来自美国哈佛医学院和英国牛津大学的施扬、Violetta Karwacki-Neisius研究小组在Nature杂志上发表题为WNT signalling control by KDM5C during development affects cognition的研究论文,这篇文章不仅揭示了神经元发育的新机制,还发现了早期胚胎事件与日后记忆障碍和焦虑的联系,强调了WNT信号通路在认知调控中的非传统新作用以及其作为智力障碍潜在治疗靶点的可能性。

本研究通过对比携带KDM5C突变的兄弟与正常人的成纤维细胞,以及野生型和Kdm5c基因敲除小鼠的神经发育过程,发现KDM5C在神经发育中起重要作用(图1)。在携带KDM5C突变的人类细胞中,中间祖细胞的产生显著受损,且神经发生减少。在Kdm5c KO小鼠中,也存在中间祖细胞和皮质层的减少,以及神经发生的发育延迟。这些结果表明KDM5C在小鼠和人类中调节相似的神经发育过程,为理解KDM5C相关神经发育障碍提供了重要线索。
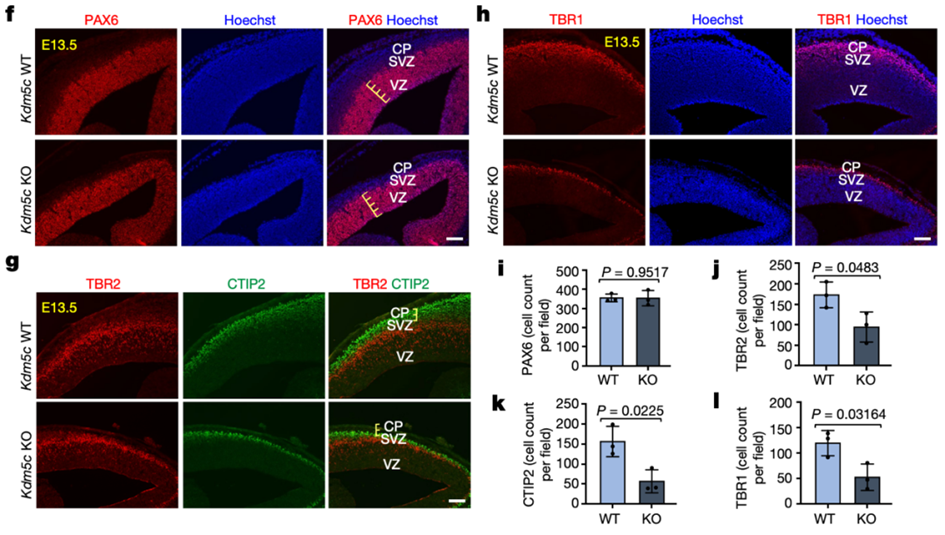
图1:KDM5C在神经发育中起重要作用。
为了深入探究KDM5C的功能机制,作者进行了体外神经元分化过程中的RNA测序分析。结果显示突变细胞在第30天表现出与校正细胞第14天相似的转录组特征,提示分化延迟。在第14天出现显著的表达差异,并在整个过程中持续存在,第30天差异最大。突变细胞中WNT-β-catenin途径基因显著上调,且WNT基因属于最早失调的基因之一,在第30天失调最强,随后无显著差异。表明突变细胞中WNT信号失调与表型差异相关。
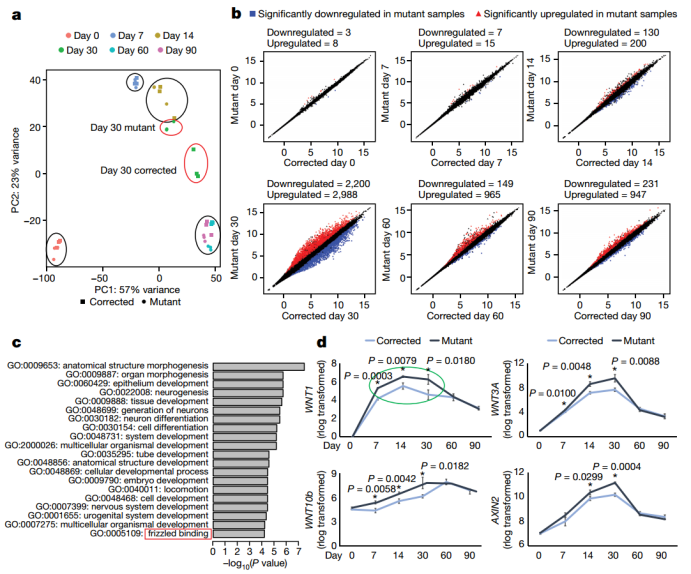
神经元分化过程中的转录组分析和GSEA(Credit: Nature)
为了确定KDM5C直接调控的靶基因,作者进行了全基因组KDM5C结合位点分析,发现WNT-β-catenin途径的关键基因CTNNB1和FZD1是KDM5C的直接靶标,并在突变细胞中上调。此外,KDM5C还与编码细胞外基质蛋白的ITGB1和ITGB1-DT基因的启动子结合,这些基因与癌症进展有关。提示KDM5C在调控神经发育和潜在癌症相关基因表达中的重要作用。
WNT信号通路在皮层神经发生中具有重要作用,但其确切作用机制复杂且不完全清楚。因此作者开发了一种新的治疗策略,通过在神经元分化早期短暂下调WNT-β-catenin活性来恢复突变细胞的正常分化。实验结果表明,这种治疗策略足以恢复中间祖细胞和早期出生神经元的形成,并使神经元标记物的表达恢复到正常水平。由此得出结论,在确定的发育阶段,WNT的不当上调是KDM5C突变细胞中神经元分化延迟的必要和充分条件。
接下来,作者研究了短暂调节WNT-β-catenin通路对整个转录组景观的影响。通过RNA-seq分析发现使用WNT抑制剂处理的KDM5C突变细胞与未处理的突变细胞相比,其转录组发生了显著变化,变得更接近于正常细胞。相反,当用WNT3A处理正常细胞时,它们的转录组变得与突变细胞相似。这种转录组的变化在细胞分化的早期和晚期都很明显,并且伴随着染色质组织的变化。这些结果进一步证实了WNT-β-catenin通路在KDM5C相关神经发育障碍中的重要作用。
相应的,作者还研究了短暂调节胚胎期小鼠大脑中的WNT-β-catenin通路是否足以引起成年后的行为变化。通过在胚胎期E13.5向小鼠侧脑室注射重组WNT3A或抑制剂IWP2,发现WNT3A处理的野生型小鼠表现出Kdm5c基因敲除小鼠相似的表型。而IWP2能够显著挽救Kdm5c 基因敲除小鼠的行为异常。此外,WNT3A处理的小鼠大脑中树突棘的密度降低,这可能与行为变化有关。表明在神经发育的关键时期,短暂的WNT-β-catenin通路调节足以调节与KDM5C突变相关的智力障碍行为表型。因此,WNT-β-catenin失调可能是人类KDM5C突变相关症状的主要原因。
综上所述,神经发育涉及祖细胞和神经元在时间和空间上的精确调节,这篇文章使用了源自人类患者的诱导多能干细胞和Kdm5c基因敲除小鼠进行细胞、转录组、染色质和行为学研究,明确了KDM5C为控制这一神经发育过程的关键因子。机制上讲,KDM5C能够直接靶向调节WNT信号通路,使其成为潜在的治疗靶点。调节WNT信号通路还会显著影响皮层回路形成所需的转录程序,具有重要的临床意义。这篇论文为系统研究神经疾病中WNT作用及调节的潜在影响提供了研究框架,为KDM5C突变相关智力障碍等神经疾病的治疗提供了新思路。
原文链接:https://doi.org/10.1038/s41586-024-07067-y













